2025年5月17日にログミーFinance主催で行われた、第103回 個人投資家向けIRセミナーの第5部・株式会社PRISM BioLabの講演の内容を書き起こしでお伝えします。
企業理念
竹原大氏(以下、竹原):株式会社PRISM BioLab代表取締役の竹原です。どうぞよろしくお願いします。本日は、先日行った2025年9月期第2四半期決算発表の資料に基づいてご説明します。
当社は「PepMetics」という独自の創薬技術を持っています。この技術を用いて、今までなかなか薬にできなかったものを薬にすることを目指しています。薬を作るのは本当に大変なことで、世界中で約30万人弱の研究者が研究していますが、毎年FDA(アメリカ食品医薬品局)で承認される薬の数は、たった30から50しかありません。
そのような狭き門ではありますが、我々の優秀なサイエンティストたちが集まり、自由な発想と技術を積み重ねることで、今までできなかった「あたらしい創薬」に挑戦しています。そのためにも、多様な才能が「あたらしい研究」にチャレンジできて、みなさまが成果を出せるような環境を作っていきます。そのようなことを組織としての「Vision」にしています。
2025年9月期 第2四半期のハイライト

竹原:第2四半期の最近の動きについてご説明します。先月発表したとおり、AI創薬のElixと業務提携を結んでいます。後ほど詳しくご説明しますが、低分子を使った技術で、創薬の中でもいろいろな場面で活用されるAIとの相性がとても良いことがわかっています。
我々は、AIを使った化合物の物性の予測など、さまざまな研究を独自でも行っています。ElixのAI技術を使って、新しい化合物の設計を協働で目指しています。これによって、従来は時間がかかり、なかなか困難だった標的にも、より効率的に創薬が進められることを期待しています。
2025年9月期 中間会計期間 損益状況
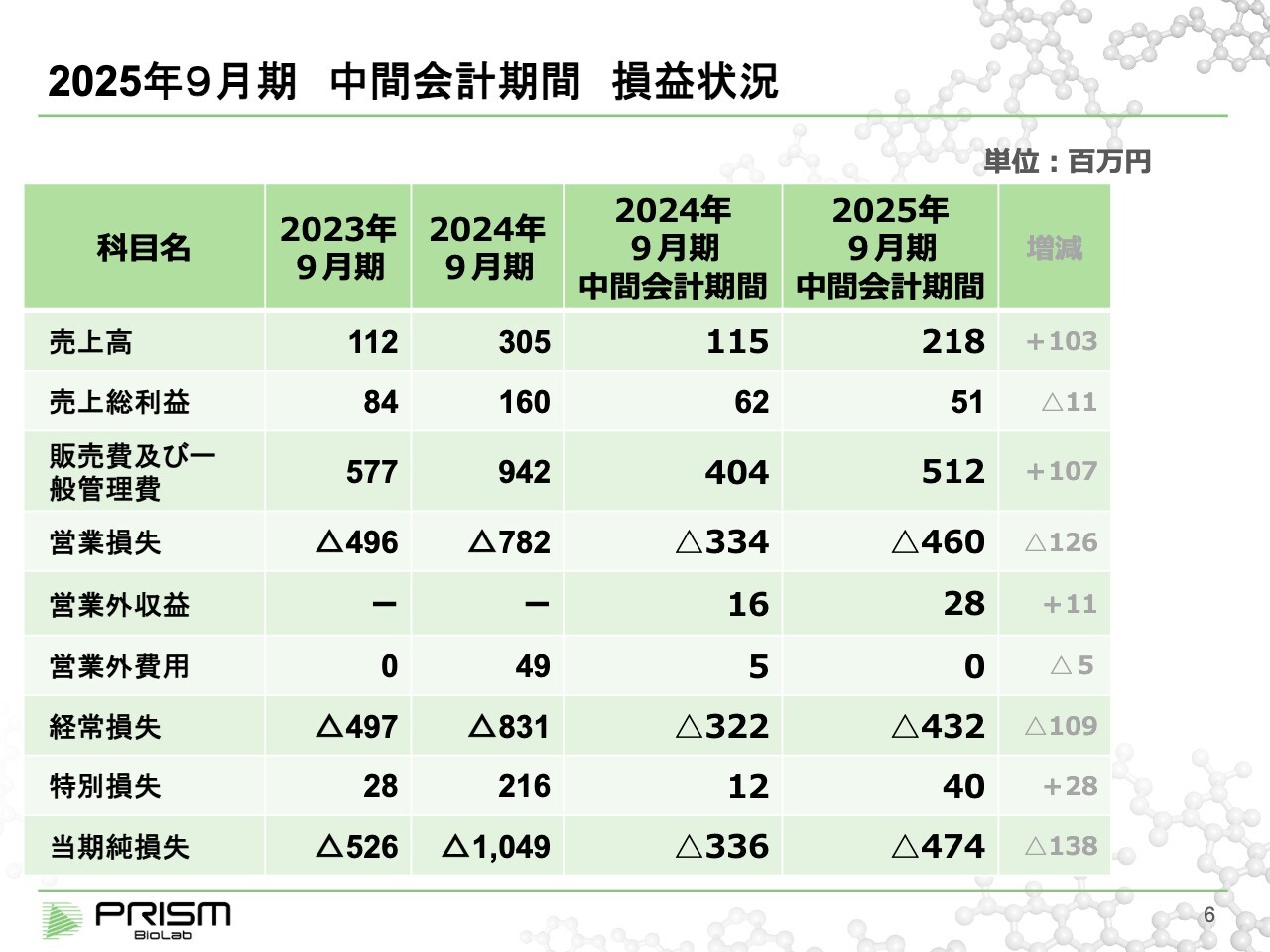
竹原:中間決算の数字について簡単にご説明します。第2四半期の売上高は約2億円で、前期の約1億1,000万円から2倍のペースで進捗しています。前期決算の最終売上が約3億円だったことから、今期はそれを上回るペースで進んでいるといえます。
一方で、研究開発を進めていくことが何より重要ですので、研究開発への投資をどんどん進めています。多少原価率が上がっているため、売上総利益については昨年第2四半期とほぼ同等となります。
最終的には、第2四半期において約4億7,000万円の赤字となっています。
2025年9月期 中間会計期間 財政状況
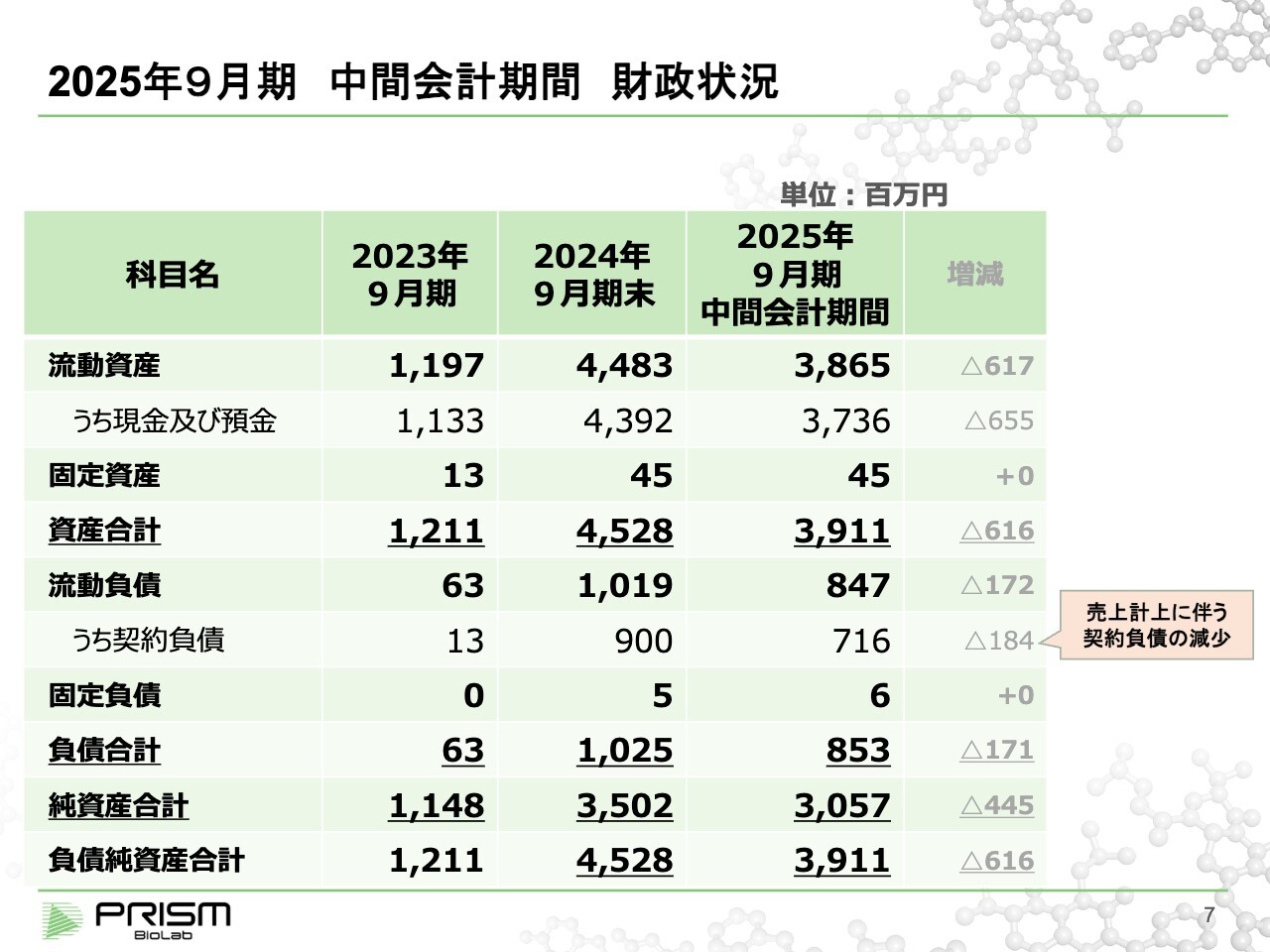
竹原:バランスシートです。期首で現金が約44億円ありましたが、現在約37億円で約6億5,000万円を消費しているかたちになります。
今期になってから、なかなか現金収入がありません。売上については、前期末で契約負債として約9億円の前受金が計上されています。主に昨年契約したEli Lilly and Company 以下、Lilly)、小野薬品工業からの共同研究費となります。現在、その共同研究費を使って進めています。
2025年9月期 中間会計期間 キャッシュフロー状況
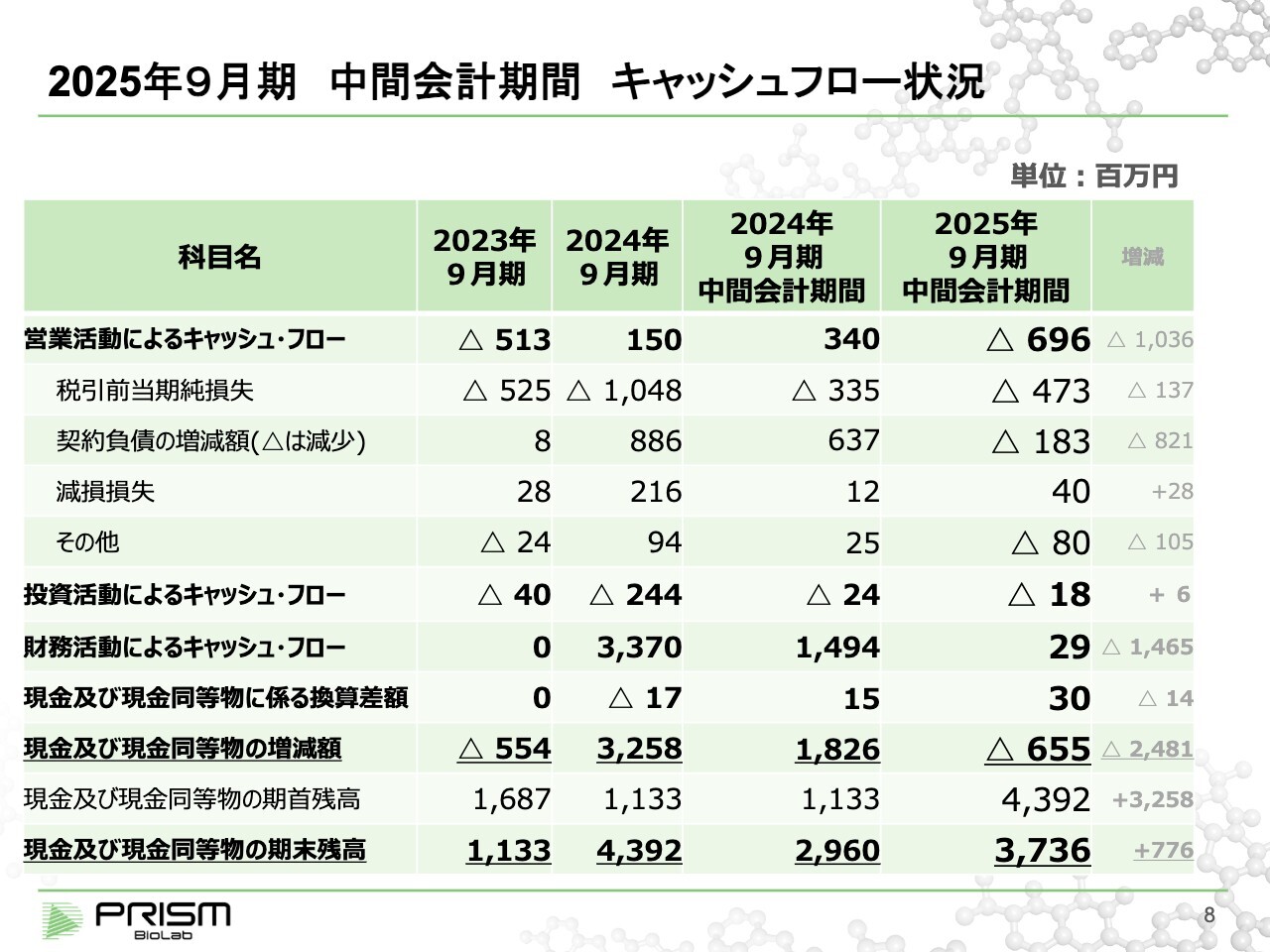
竹原:キャッシュフローとしては、今期の損失は約4億7,000万円です。加えて、先ほどの前受金から取り崩している1億8,000万円などがあり、約6億9,000万円のマイナスとなります。バイオベンチャーというのは、収益が一度に来て、その後研究開発にどんどんお金を使っていくビジネスモデルになります。
事業進捗を示す指標:段階別プログラム数の推移
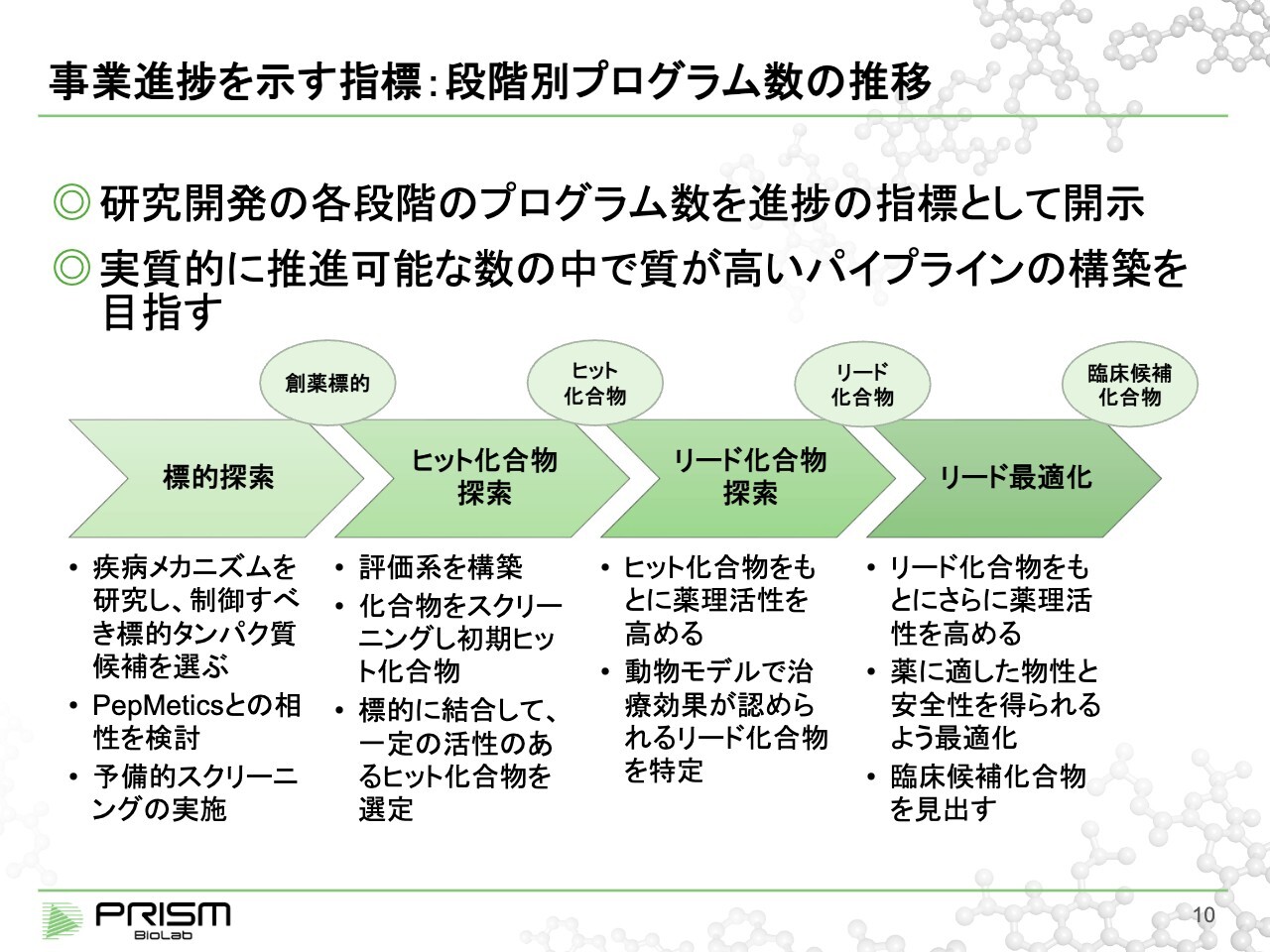
竹原:現在の事業の進捗についてご説明します。製薬会社や創薬の中でよく使われる「臨床試験のフェーズ」とは、開発がどこまで進んでいるか進捗度合いを表す指標で、パイプラインで示すことが多くなります。
我々がメインとしているのは、臨床試験に進む前の、臨床候補化合物という薬の種になる化合物を作る段階です。「臨床試験の前」というのが重要になります。我々は、それをわかりやすく4つの段階に分けて管理しています。
その段階に応じて、みなさまにご説明させていただきたいと思います。まず重要なのが、どの標的が薬に一番つながりやすいか探索する「標的探索」です。ここで正しい標的を選ぶことが、その後の投資の効率を良くします。
標的が決まれば、次は我々の一番強みとしている「ヒット化合物探索」です。困難な標的に対しても、ヒット化合物を探し出していきます。ヒット化合物というのは、標的に対して、なんらかの活性がある最初の化合物です。それを出していくプロセスになります。
出てきた化合物を改善し、対象疾患の動物モデルに対して、効果が確認できるような化合物を作る「リード化合物探索」に入っていきます。次に、新薬の最終的な候補化合物である臨床候補化合物を作ります。これを「リード最適化」と呼んでいます。
4つの段階には、質の高いプログラムがきっちりあることが重要です。単に多ければよいわけではありません。バイオベンチャーですから、当然リソースとしては限りがあります。あまりにもたくさんのパイプライン並べていても、一つひとつのプロセスを確実に進捗させられるかといえば、なかなか難しくなります。我々は、ある程度厳選したものを常にそろえておきます。
もう1つ重要なのが、4つのステップを超えても、すべてのプログラムで臨床候補化合物ができるわけではないということです。薬になる可能性は数万分の1といわれており、この中で臨床候補化合物ができるようなプログラムはすべてではありません。
したがって、必要に応じて途中で中止することも視野に入れながら、常にパイプラインの中にあるプログラムを健全なかたちにすることを目指しています。
自社開発事業(期首設定目標と進捗状況)
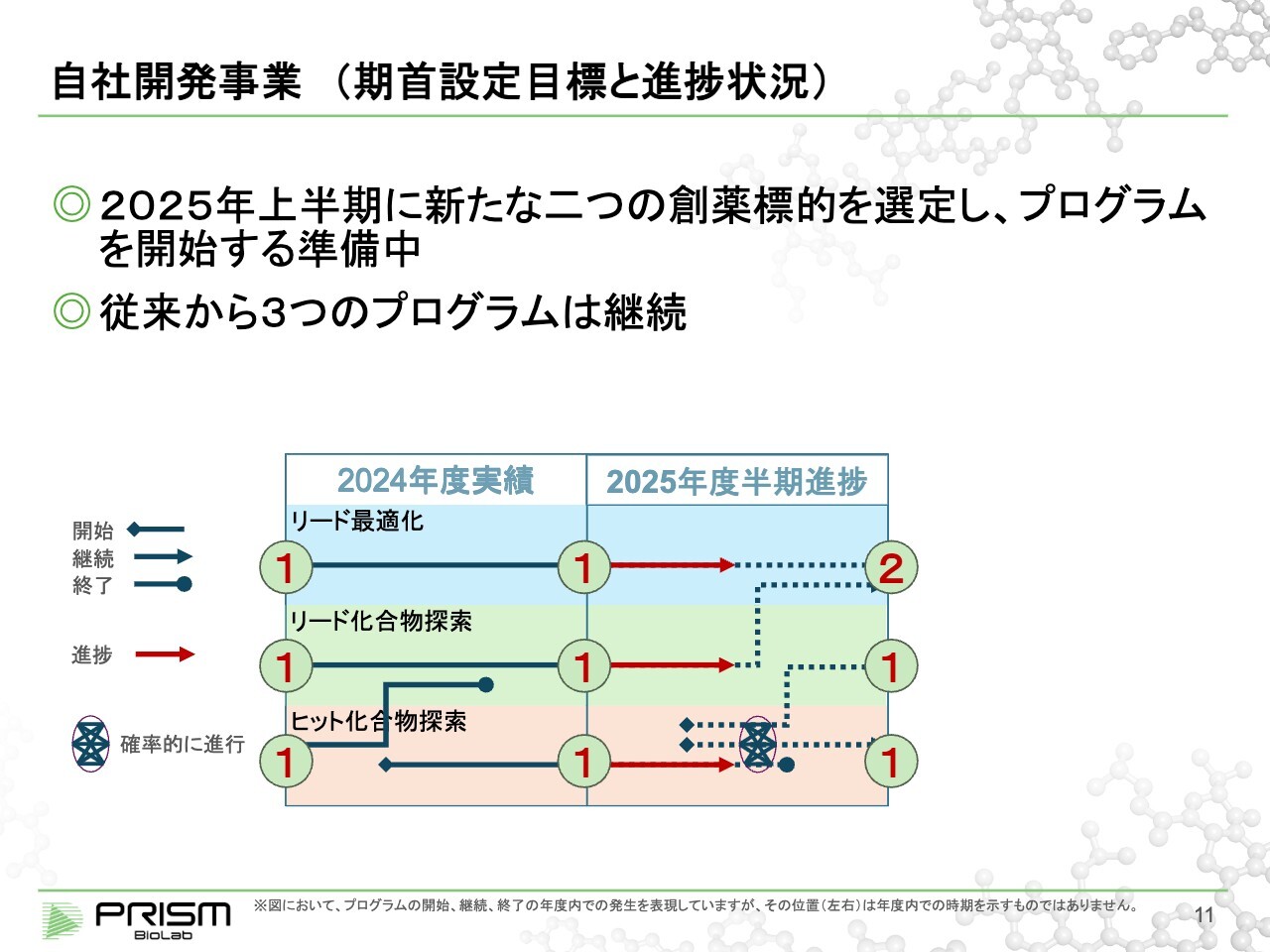
竹原:みなさまにわかりやすくご説明するために、自社開発と共同開発の2つのビジネスモデルについて、スライドの表にまとめています。期首に、2024年度の実績と2025年の目標をご説明した際の資料です。
昨年末に、最終的な臨床候補化合物を探してヒット化合物が見つかったプログラムが1つ、リード化合物を探しているプログラムが1つ、ヒット化合物探索に入る段階のプログラムが1つあります。この状況から始まり、今期末にそれぞれ②、①、①というかたちを目指しています。
2025年度半期までの進捗については、スライド図の赤い線で示しています。3つのプログラムはそのまま進んでいますが、新しく2つ立ち上げることを目標にしています。そちらについては、標的の選定までは終わっており、現在は立ち上げるための準備活動に入っています。基本的には、期末までに立ち上げていきたいと思っています。
共同開発プロジェクト(期首設定目標と進捗状況)
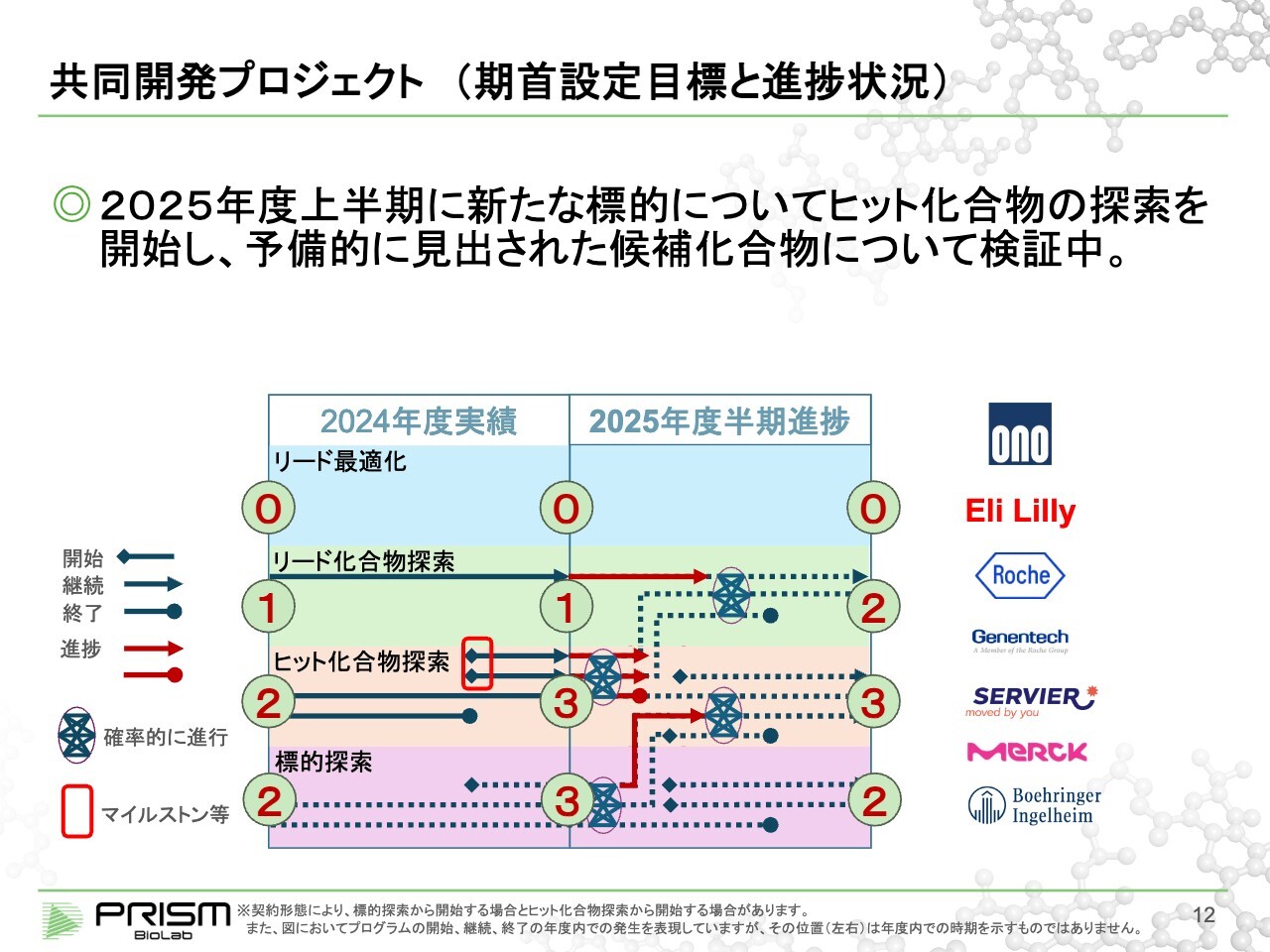
竹原:共同開発プロジェクトについてです。後ほど詳しくご説明しますが、スライド右側に記載のように、グローバル大手を含めた7社と共同開発を進めています。
2024年度は、上から⓪、①、②、②の段階から始まり、今期期首には⓪、①、③、③のかたちでした。2025年度は、⓪、②、③、②まで持っていくことを目標にしています。赤い四角で囲っている部分はマイルストンイベントになることが多く、このような段階で我々は一時金を受け取っています。
2025年度半期までは、現状でそれぞれ進捗はしていますが、ヒット化合物探索の途中で1つ中止となっています。一方、1つが標的探索からヒット探索に進んでおり、現在ヒットの確認作業を行っています。新しいプロジェクトが始まっていると考えていただければと思います。
そのような意味では、期首の目標に向けて、今のところ順調に進んでいると考えています。
創薬基盤ベンチャー ⇒ PPI の総合的先端技術をリードする創薬企業
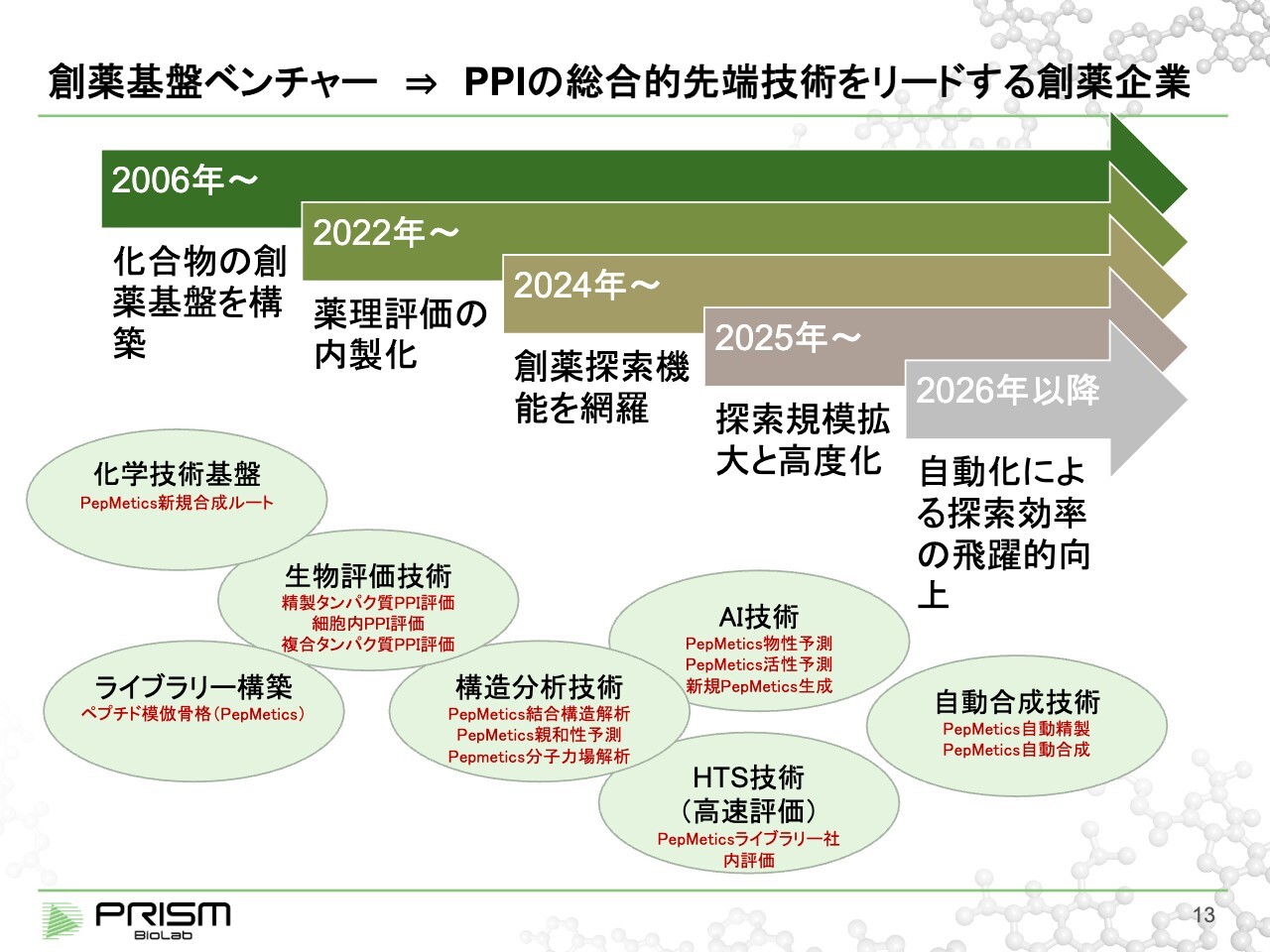
竹原:プログラムを進めていくと同時に、創薬基盤自体もどんどん発展させていくことが重要だと考えています。
当社は2006年に設立され、合成化学の技術を中心とした創薬基盤を持っていました。主に、化学技術を使ってライブラリーを構築し、ヒットを探すためのスクリーニングに使ってもらうことが我々のコアとなる技術です。ただし創薬には、生物も含めてさまざまな機能が必要で、当時は外部に頼っていた状況でした。
2022年から、そのようなものも総合的にできる創薬企業として、創薬基盤だけのベンチャーから、創薬を自分たちで実施できる会社に展開していこうと、機能の拡大を行っています。2022年には、薬理評価の内製化を行いました。薬理評価とは、細胞などのモデルで化合物の効果を確認するものです。
我々が狙っているのは大変難しい標的で、評価技術も合ったものが必要です。そのような意味では、内製化することでノウハウを貯め、後ほどご説明するPPI創薬についての総合的な技術を作っていきたいと考えています。
2024年には、化合物が結合しているか正確に測り、どのように結合しているか構造分析する生物物理の機能も拡張しています。今年度に入ってからは、先ほどご説明したAI技術を取り込み、ライブラリーをそのまま社内で大量に評価するHTS技術も活用しています。今後の展開としては、自動合成を含めて飛躍的に創薬基盤を強化していこうと考えています。
PepMeticsがあたらしい創薬領域を創る可能性
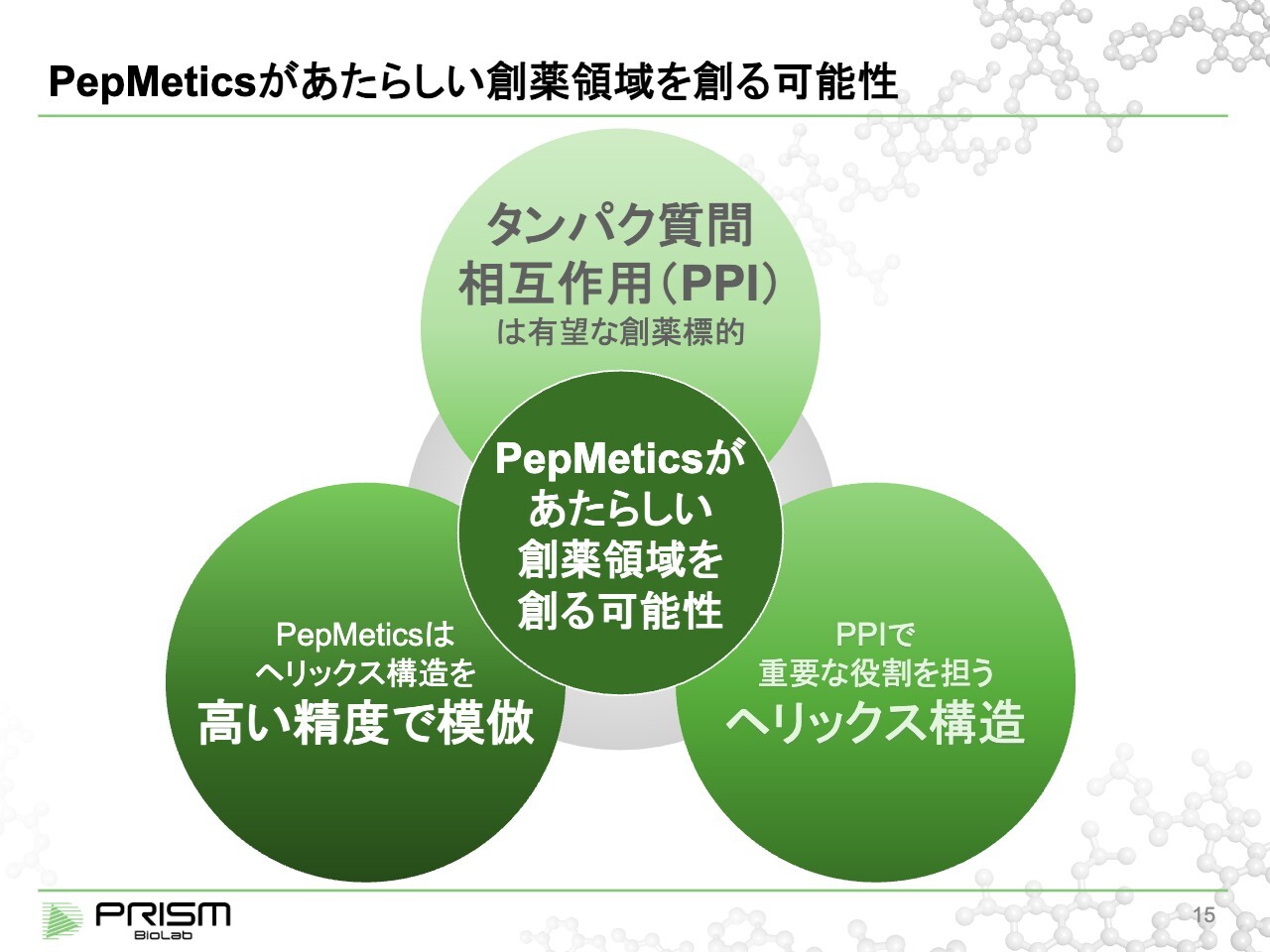
竹原:「PepMetics」について、我々が目標を実現するためにどのような技術を持っているのかについてご説明します。「PepMetics」が新しい創薬を作るとお話ししていますが、どのようにそれを実現できるのか、3つのステップでご説明します。
タンパク質間相互作用(PPI)は人間の体にとって極めて重要で、薬を作る上で大きな可能性を秘めています。PPIを制御するにあたり、重要なキーワードとしてヘリックス構造があります。これは、タンパク質の一部の構造です。我々の「PepMetics」技術は、ヘリックス構造を高い精度で模倣できる、初めての低分子ツールです。それにより、従来できなかったPPIの制御が、低分子によってできるようになります。
タンパク質間相互作用(以下「PPI」)は有望な創薬標的
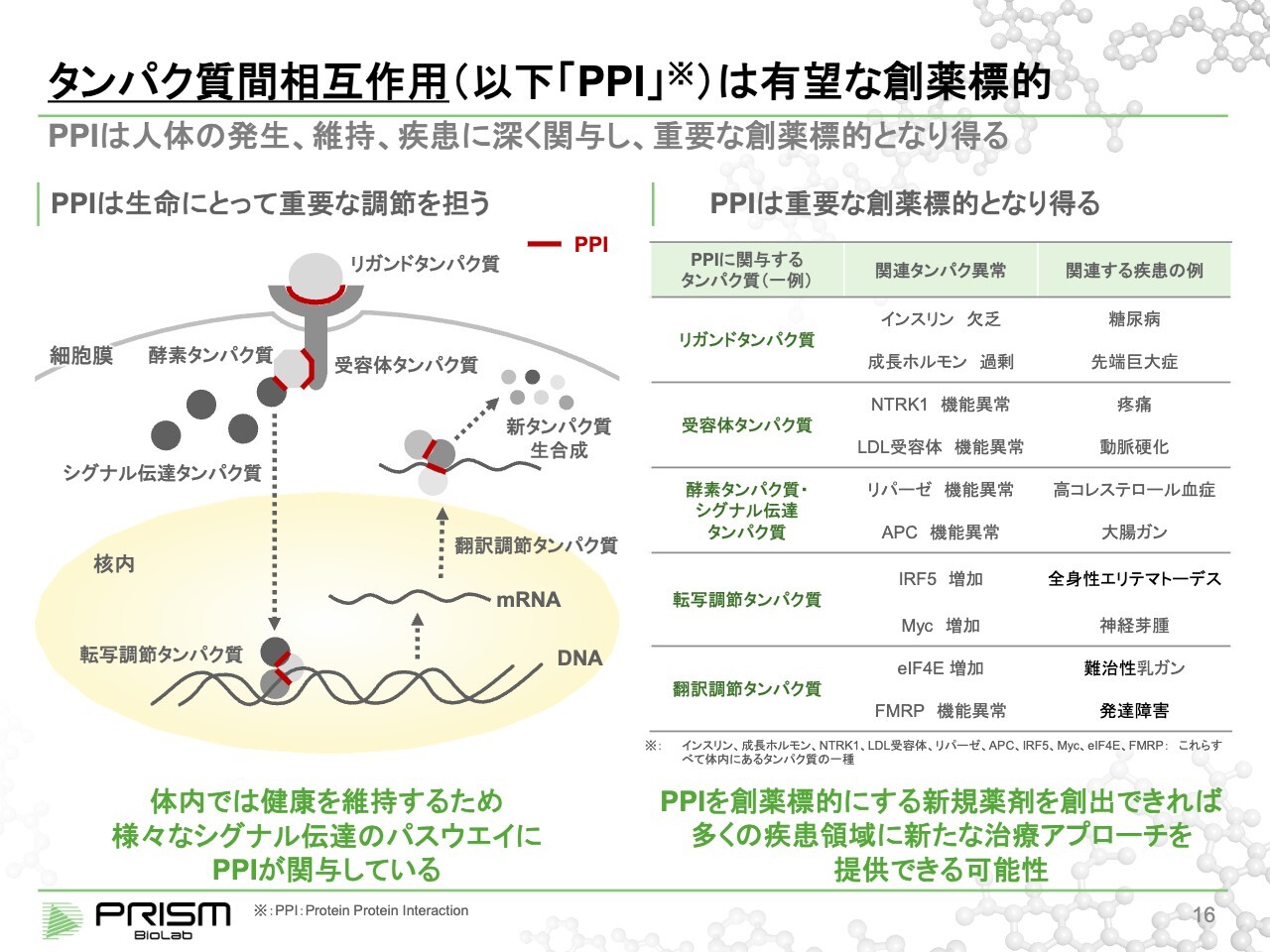
竹原:PPIについてです。人間の体は、大変複雑なさまざまな信号をコントロールしています。生まれて、育って、恒常性の維持や病気との闘いなどを綿密に行っています。それを制御するために最も重要な役割を果たしているのがタンパク質です。
タンパク質が信号を伝えるために、タンパク・タンパク結合を行います。例えば、スライド図上部のグレーの部分は細胞膜を示しています。細胞膜の外側から、リガンドタンパク質が受容体タンパク質と結合します。
受容体タンパク質の細胞内で、酵素タンパク質やシグナル伝達タンパク質に信号が伝達され、核の中に入り、DNAから遺伝子、メッセンジャーRNAを読み出します。読み出されたメッセンジャーRNAが新しいタンパク質の設計図となり、新タンパク質を作り出します。
赤い線は、すべてタンパク・タンパク結合です。タンパク質は正確に、選択的に、適切なタンパク質と結合することによって機能します。環境によって組み合わせが変わっていき、例えば病気と闘ったり、増殖が必要な時には増殖のシグナルを出したりして、人間の体を守っています。
ところが、それが異常になってしまうと、さまざまな疾患となります。タンパク・タンパク結合を低分子で制御することで、元のかたちに戻していくのが我々の技術です。
PPIで重要な役割を担うヘリックス構造
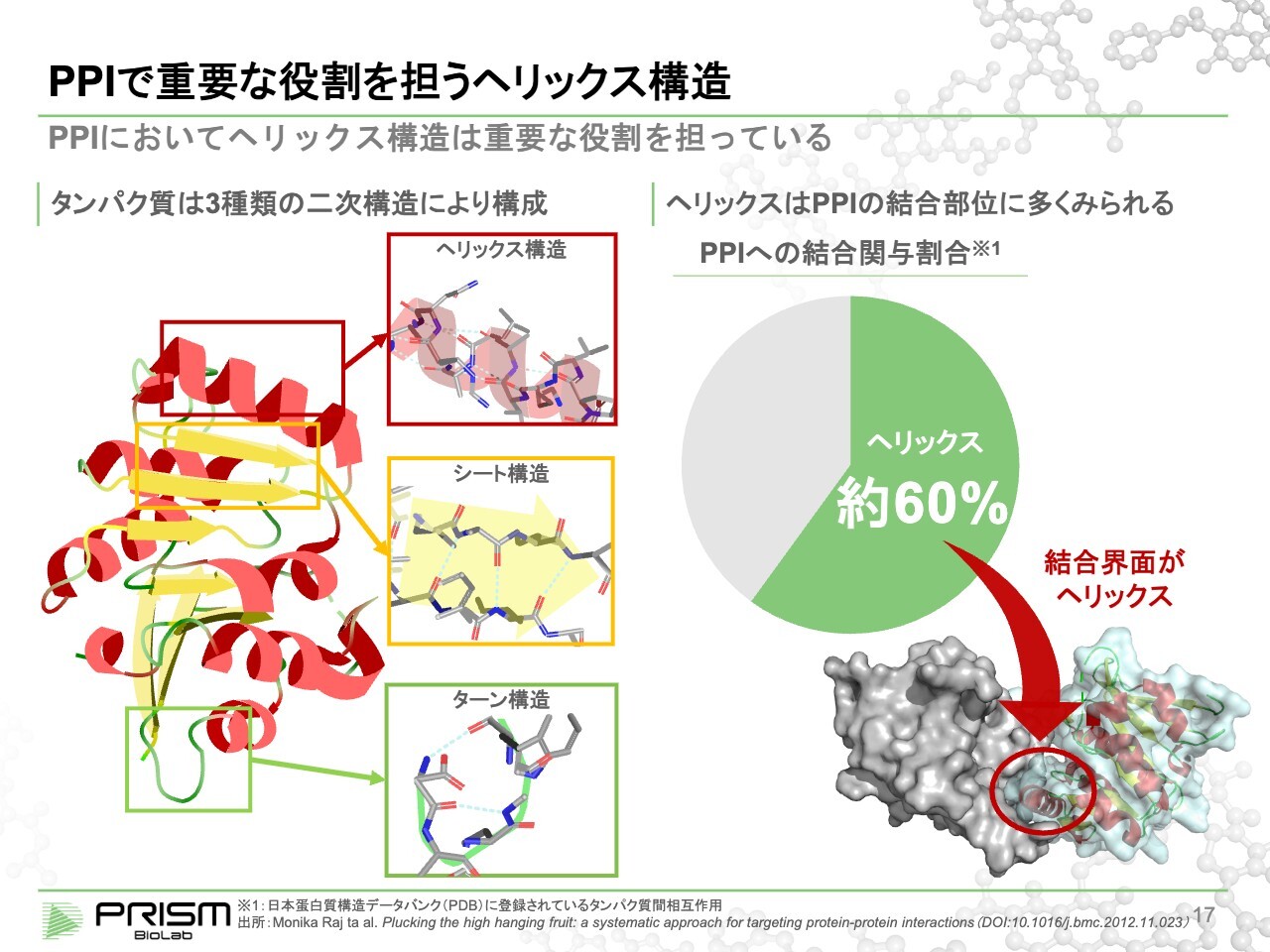
竹原:タンパク・タンパク結合はどのように行われるかについてご説明します。タンパク質は、1本の長いアミノ酸の紐で、それが正確に一定の形に折り畳まれることで、機械的に作用していきます。
同じ形に正確に折り畳まれるために、単純な安定構造が3つあります。ヘリックス構造、シート構造、ターン構造です。これらは、それぞれ部分的に安定な構造で、それが組み合わさるかたちで、スライド左図のように一定の構造を作り出します。
3つの構造の中で、タンパクとタンパクが結合する界面で最も多く使われているのがヘリックス構造だといわれています。そのため、ヘリックス構造をうまく制御できれば、タンパク・タンパク結合を制御できると知られています。
ところが、ヘリックス構造は名前のとおりヘリックス(螺旋状)で、4つのアミノ酸で約1回転します。これを真似ようとすると、四方八方に伸びている手を3次元的に模倣しなければなりません。
従来の低分子は作りやすさもあり、ベンゼン環を使った、ほとんど平面的に合成された化合物でした。天然物はかなり立体的なものが多いのですが、合成化合物はほとんど平面的だといわれており、ヘリックス構造を模倣するのは難しいといわれてきました。
当社のプラットフォーム基盤技術「PepMeticsテクノロジー」

竹原:我々の技術では、スライド左図に緑色で示した2つの輪が、ある角度をもってかっちり固まって3次元的に安定する「骨格」を作りました。その付け根から、さまざまなアミノ酸と結合できる合成方法を総合して作り、現在ではアミノ酸のすべてのパターンで作り上げることができるようになっています。
それにより、従来難しいといわれていたヘリックス構造を低分子で模倣することができるようになったことが大きなポイントです。
化合物の設計におけるPepMeticsの柔軟性
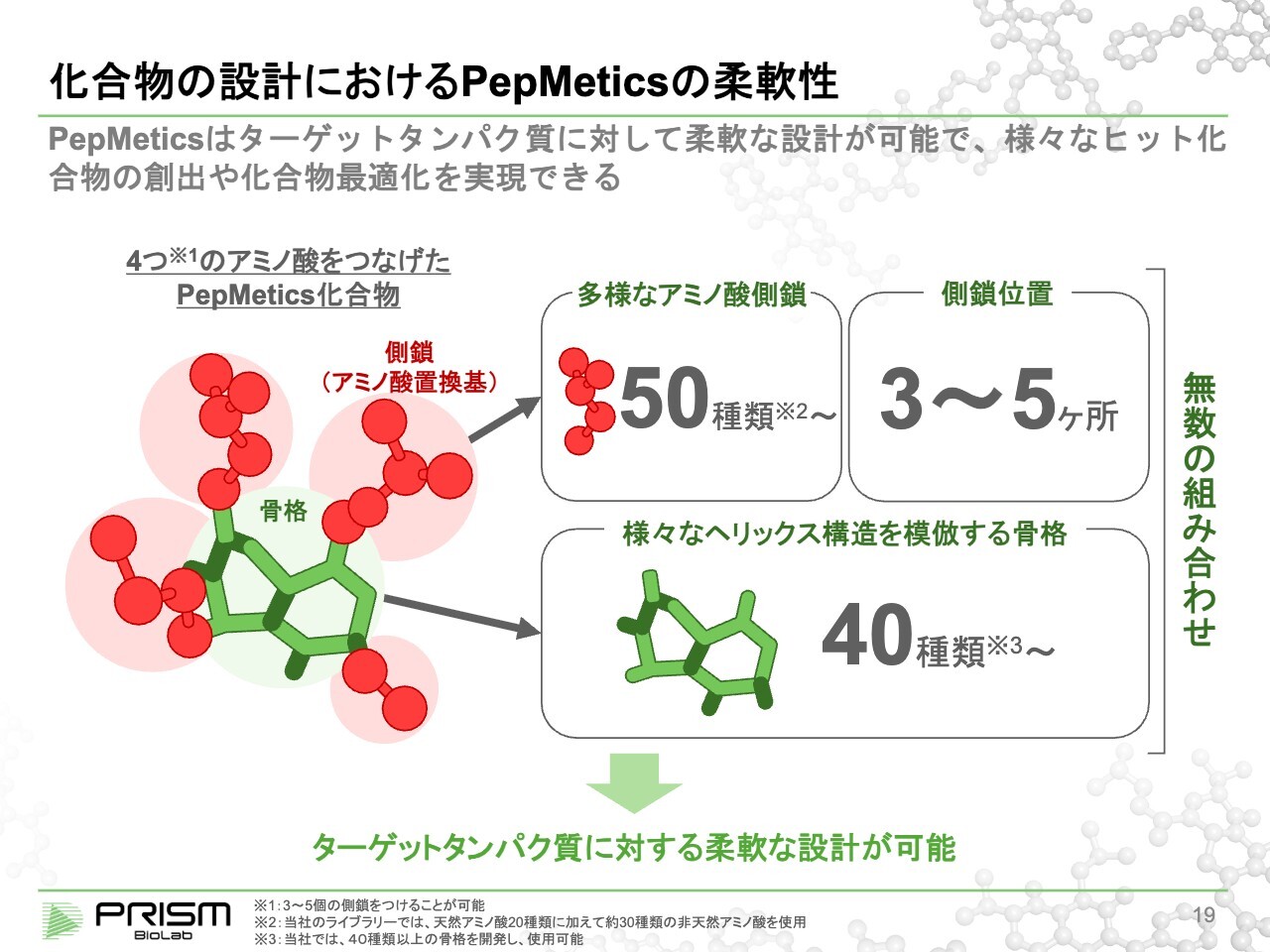
竹原:ヘリックス構造といっても1つの形ではなく、少しゆがんでいたり伸びていたり、いろいろなかたちがあります。我々は40種類以上の「骨格」と、それに対するアミノ酸もさまざまなものを用意しています。人間の体は20種類のアミノ酸しか使わないのですが、非天然のものを含めて50種類ぐらいを標準的に用意し、ライブラリーを作っていきます。
理論的には、例えば4つの手の化合物を作ろうとすると、40種類×50種類の4乗で2億5,000万通りの設計ができます。我々は3万弱の化合物をすでに合成し、ライブラリーとしてスクリーニングできるかたちになっています。
「細胞内」PPIをターゲットとする創薬の課題
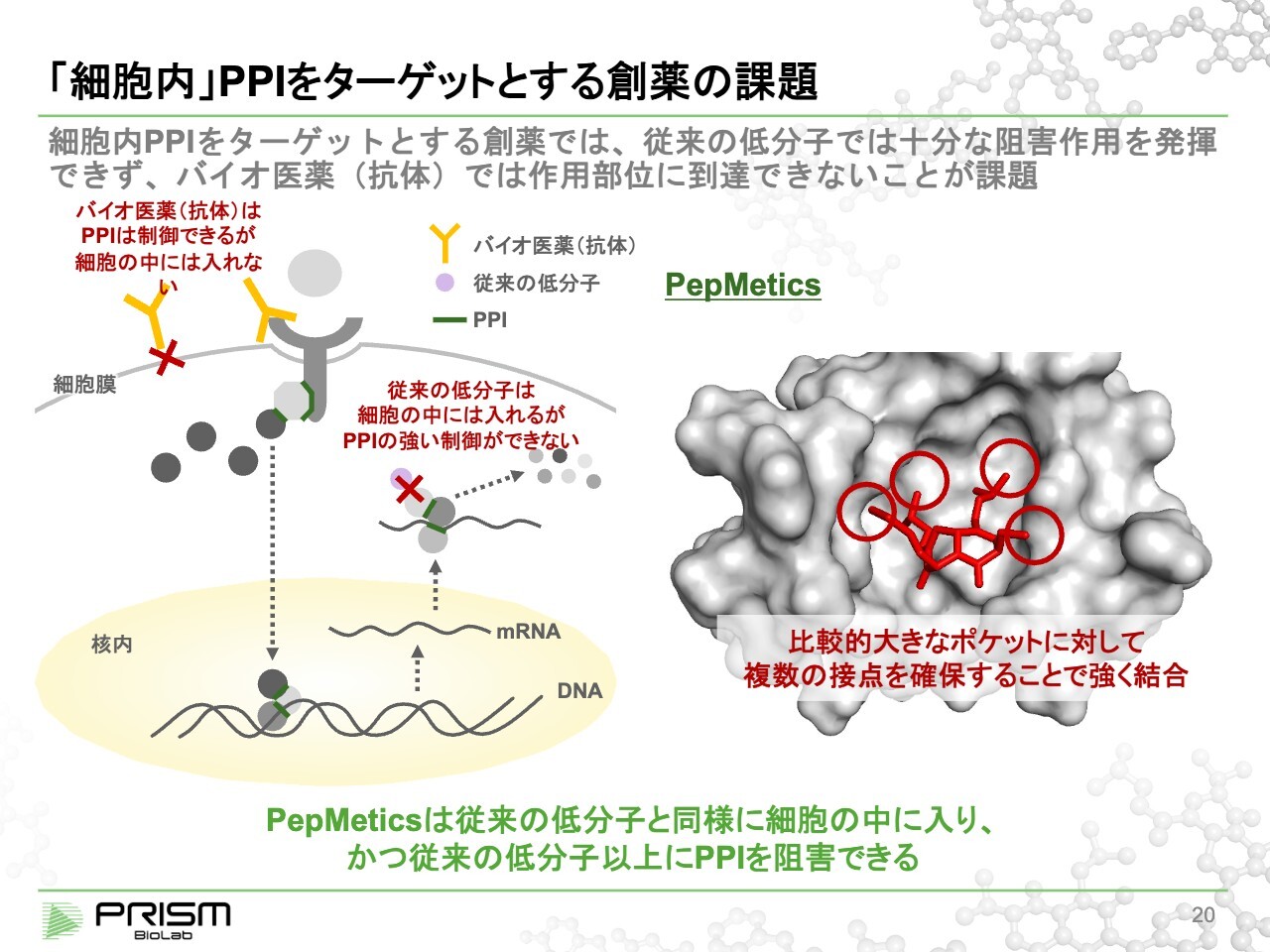
竹原:従来、PPIは低分子ではなかなか制御できません。スライド右図のグレーのポケットは大きすぎて、従来の低分子では無理だといわれていました。このポケットは、ヘリックスの棒が縦にスポッと入る穴です。我々は「PepMetics」を使い、その一部を化合物で模倣して、丸い手に4つで一度に結合するという、今までとは異なる結合様式で、大きな穴でも制御できるようになりました。
従来、PPIは低分子ではできないといわれていたため、図の黄色い部分にあるような抗体やタンパク質など大きな分子で制御しています。細胞の外側では大きな分子でもよいのですが、大きすぎて細胞の中に入れないのです。
先ほどご説明したとおり、細胞の中でもさまざまなPPIが重要な役割を占めており、そこには創薬標的としてたくさんの標的がありますが、今まで手が届かなかったのが実情です。それに対して、我々の化合物は細胞の中に入っていって、制御できるところが大きな特徴になります。
細胞内 PPI に対する他モダリティとの比較優位性
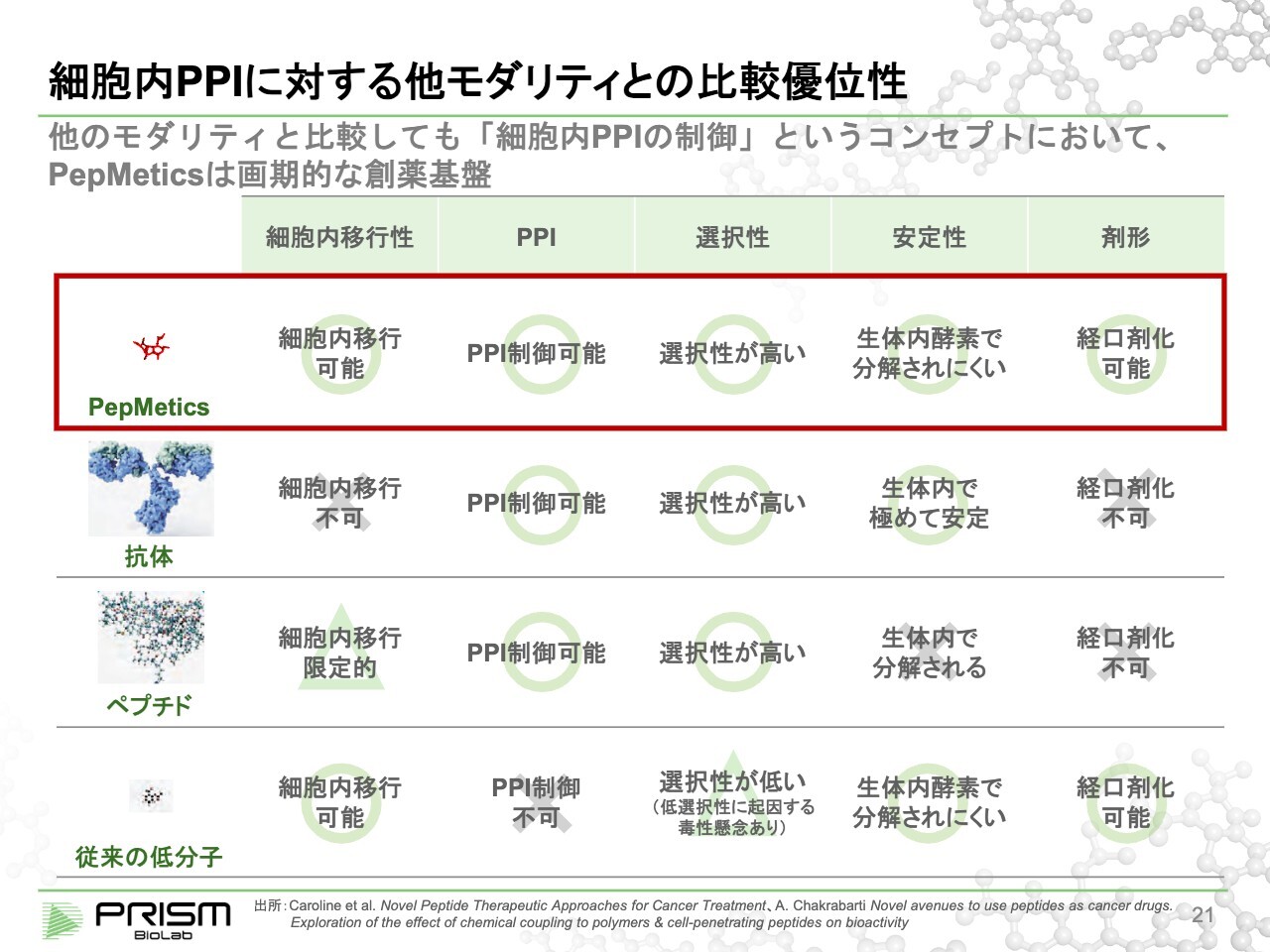
竹原:以上のご説明をまとめると、スライド一番下にあるように、従来の低分子は、細胞の中には入れますがPPIは制御できません。その上の抗体やペプチドは、PPIは制御できるものの細胞の中に入るのは困難です。
我々の化合物は、細胞の中に入り、PPIも制御でき、安定性も十分保てることから、経口剤までもっていけるところが大きな特徴になります。
天然物に類似する構造を有する PepMetics
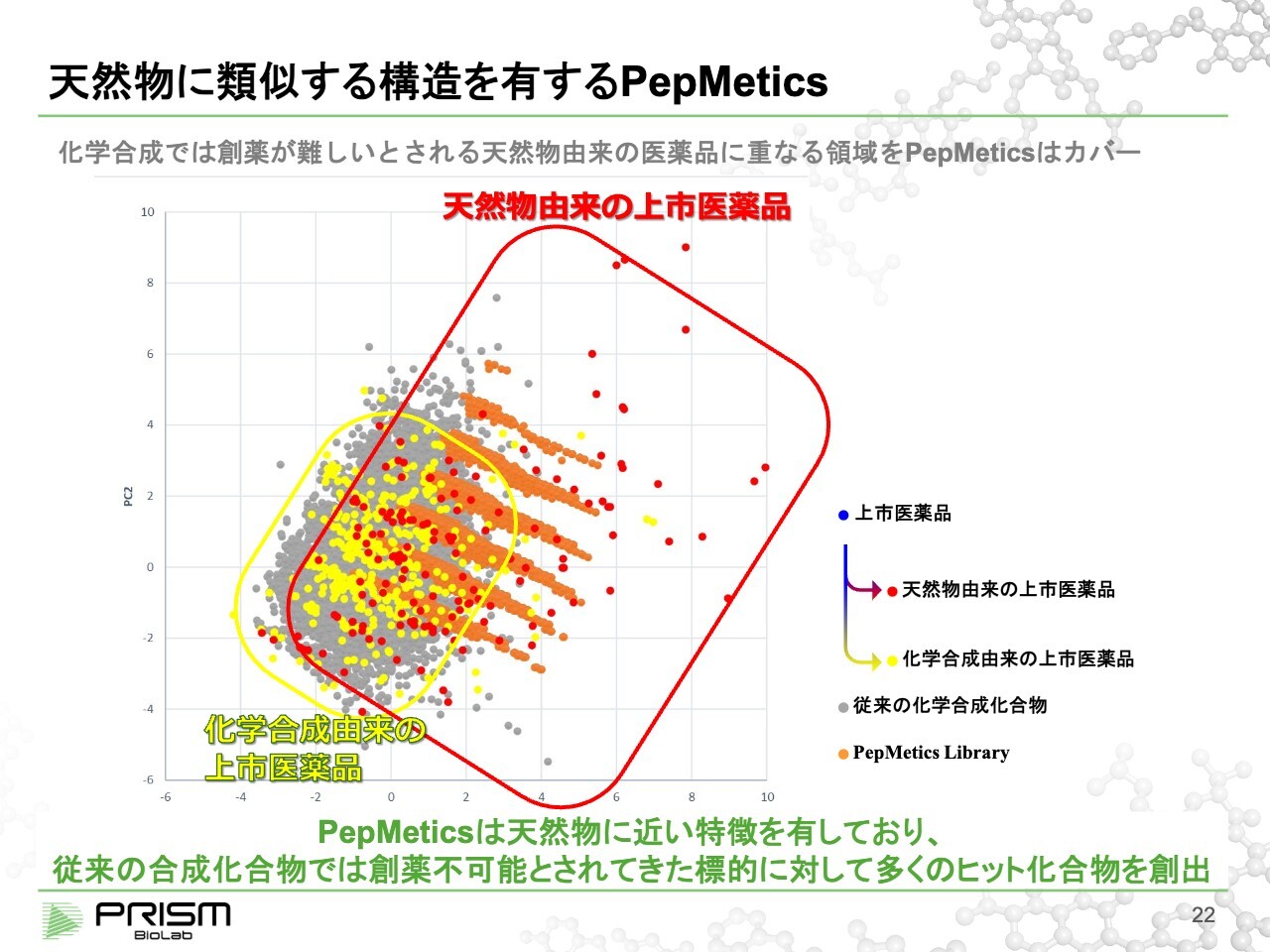
竹原:スライドでは、従来の低分子との比較をわかりやすくするために、上市医薬品を青い点で示しています。主成分分析という数学的なモデルを使って、2次元平面上に散らばらせたものです。従来の化合物をスクリーニングして使われていたものを重ね合わせると、だいたい重なるため、そこからたくさんの薬が作られてきたことを示しています。
我々の化合物を重ねると右側にずれています。特徴を示すために、青い点の上市医薬品を天然物由来と合成物由来に分けると、我々がカバーしているのは、今まで天然物でしかカバーできなかった領域です。天然物は見つけるのが大変で合成も難しいため、薬が作りにくいといわれていますが、我々はその部分を低分子で置き換えることができます。
当社のビジネスモデル
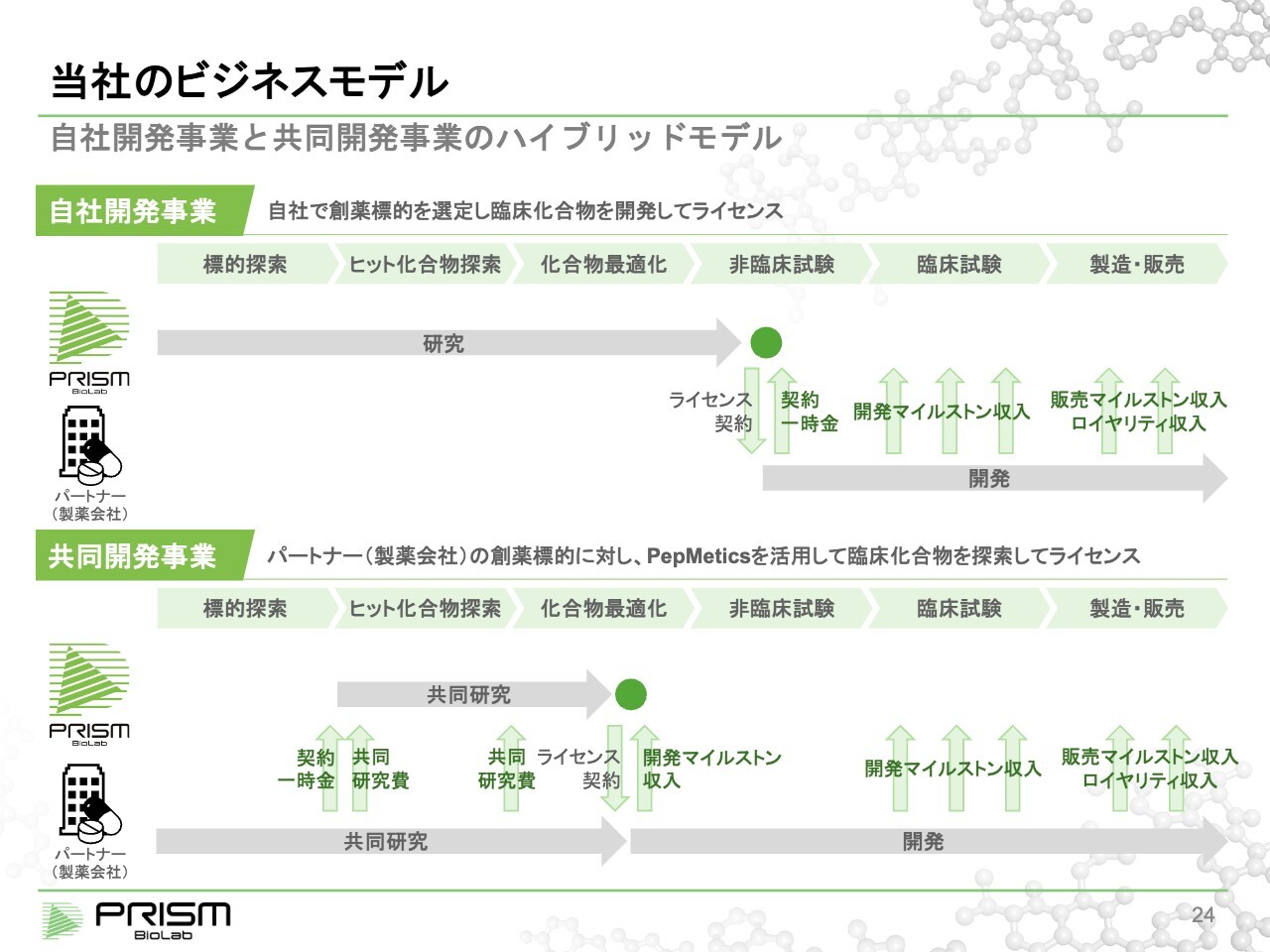
竹原:この技術を使い、我々は2つのビジネスモデルを進めています。1つ目は、自社開発事業です。自社で創薬標的を選んでヒット化合物を探し出し、化合物を最適化し、臨床試験に入る前の段階で製薬会社にライセンスします。3年から5年かかり、数億円の投資を行うため、ハイリスクではありますが大きなリターンが見込まれます。
2つ目は、共同開発事業です。製薬会社がすでに持つ標的で、なかなかヒット化合物が見つからない場合に、我々の技術を使って共同開発していくものです。最初に契約一時金や共同研究費などのコストが支払われるため、プロジェクト単位でいえば、はじめから採算が取れるかたちで進められます。当然ながら、最終的なリターンについては自社開発ほど大きくはなりませんが、安定的な事業を営むことができます。
当社の各事業の特徴
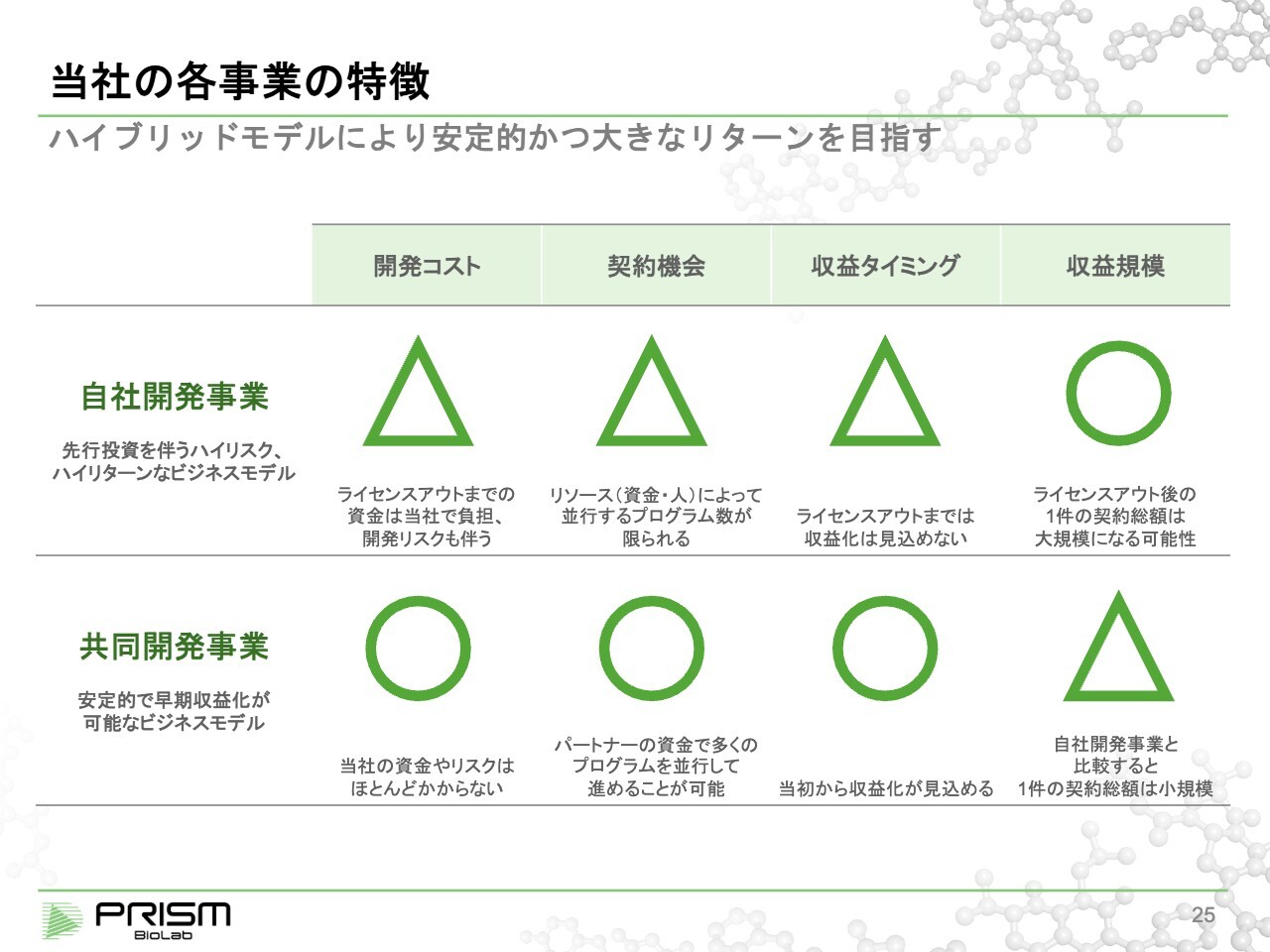
竹原:安定的な共同開発事業と、ハイリスク・ハイリターンな自社開発を組み合わせることで、事業を進めながら大きなリターンを得ることを目指しています。
自社開発から共同開発への展開
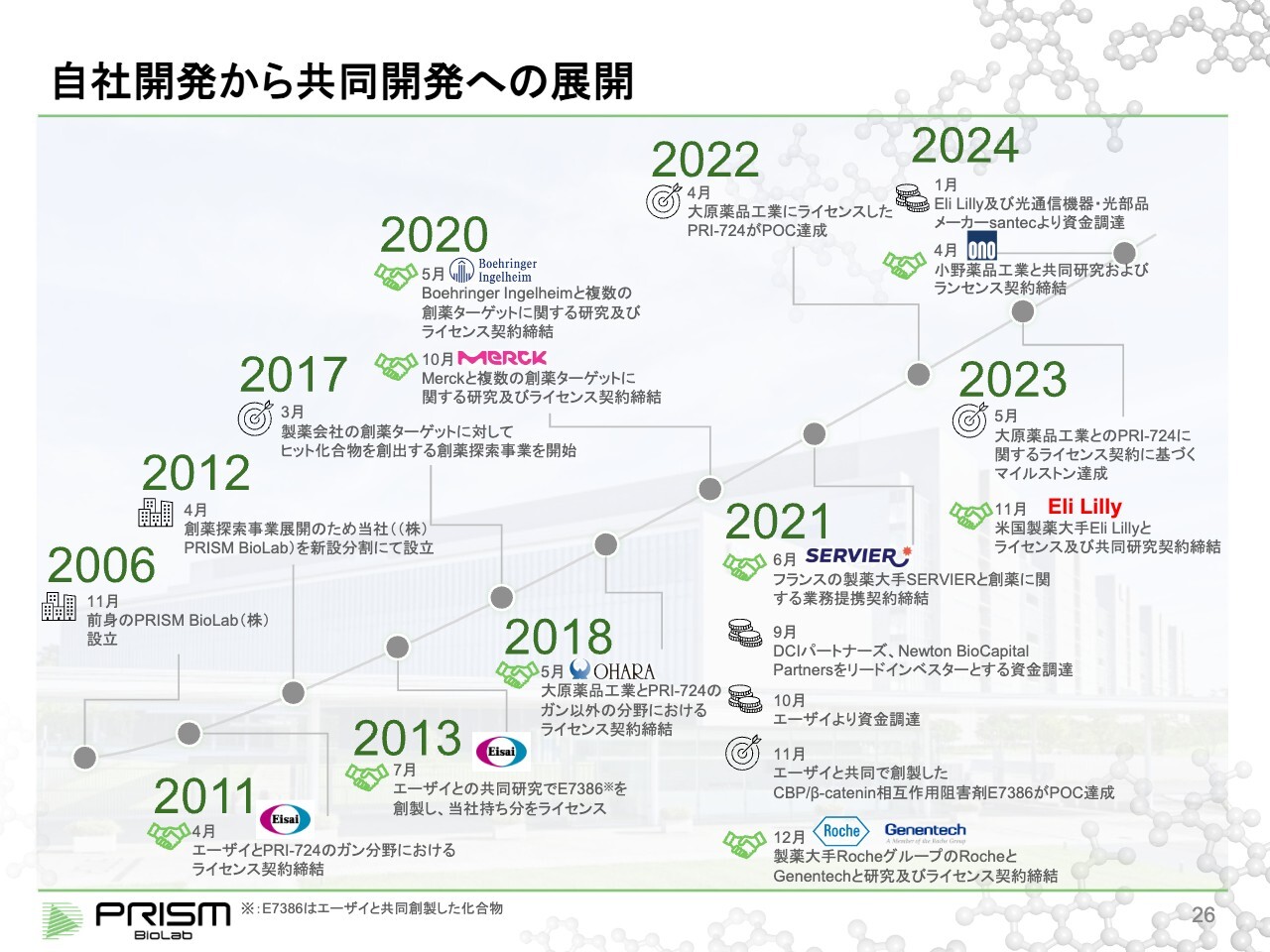
竹原:当社の設立からの歴史です。2006年から2017年、2018年ぐらいまでが第1期です。この間に、プラットフォームをきっちり作り上げ、プラットフォームが確実に薬を作れることを示すために、まず自社開発のプログラムを1つ作りました。
2011年には、エーザイにライセンスアウトし、その後共同で開発を進めています。そちらが十分な実績を出してきたところで、共同開発事業を中心に、2020年頃からBoehringer Ingelheim、Merck、Roche、Genentech、SERVIER、Lilly、小野薬品工業と、さまざまな製薬会社との契約を進めてきています。
現在は、共同開発と自社開発の両方を行うビジネスモデルとなっています。
自社開発事業

竹原:自社開発事業でライセンスアウトした案件の進捗についてご説明します。現在、2つのプログラムをライセンスアウトしており、どちらも臨床第Ⅱ相試験、フェーズ2を進めています。人の臨床試験の中でなんらかの薬の効果が認められるPOC(Proof of Concept)まで来ています。POCを得ることで、その後の成功確率は格段に上がっていきます。
エーザイでは、エーザイが開発した抗ガン剤の「レンビマ」との併用試験を進めています。子宮内膜ガンにおいて注目すべきデータが出ており、2031年3月までに承認を取ることを目標に進めています。大原薬品工業とは、線維症のプログラムを進めています。
自社開発事業: E7386
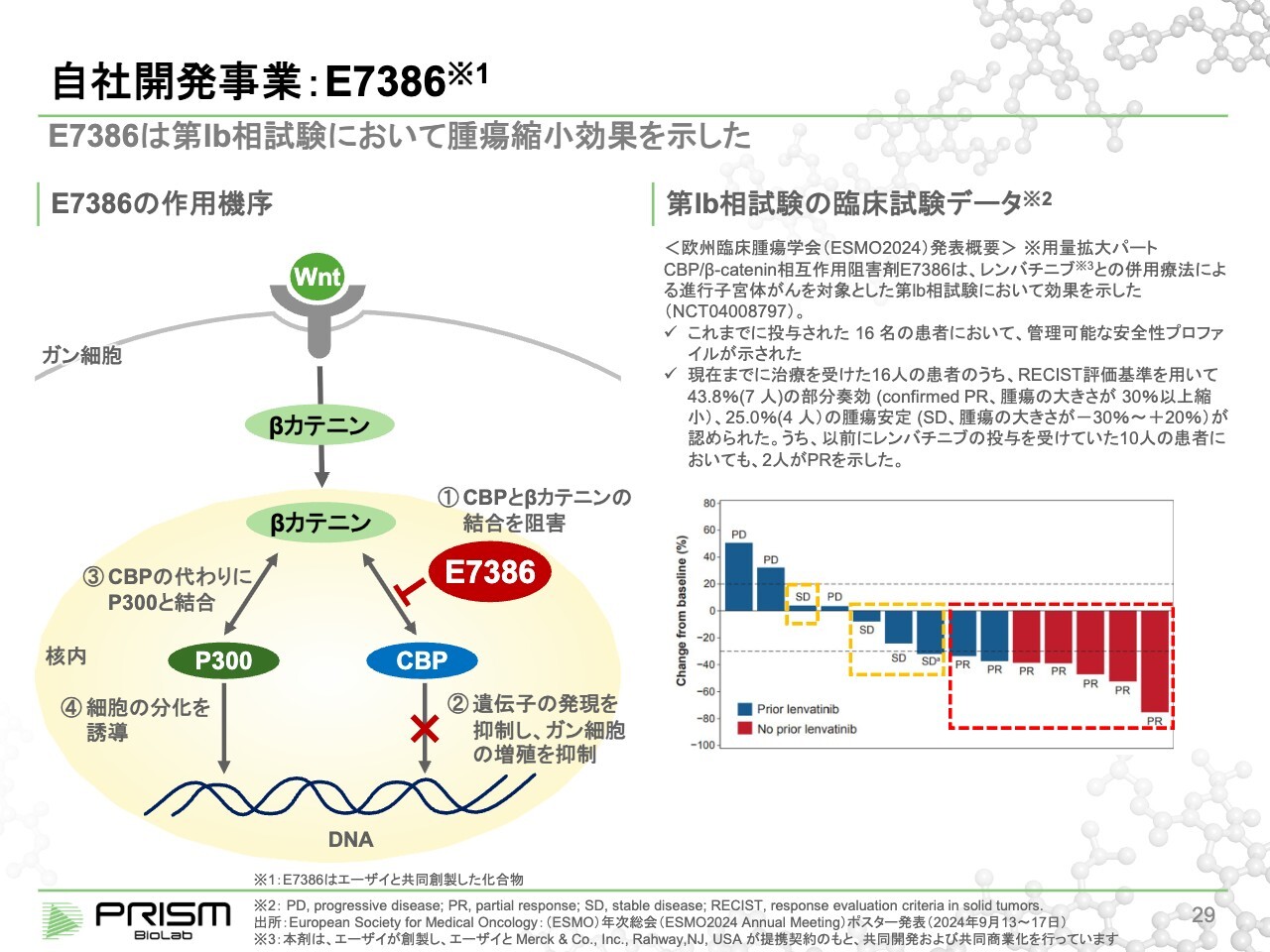
竹原:「E7386」のメカニズムを簡単にご説明します。エーザイと大原薬品工業にライセンスアウトしている2つは同じ「Wnt pathway」を狙っています。エーザイとはがんの領域、大原薬品工業とはがん以外の特に線維症専用の領域で提携しています。
「Wnt pathway」は1980年代から、がんや線維症などさまざまな疾患に関係することが知られており、多くの臨床試験が行われてきましたが、すべて毒性の問題でストップしています。「Wnt pathway」は止めると毒性が出ることが有名になっています。
我々の化合物は「Wnt pathway」全体を止めてしまうのではなく、「Wnt pathway」シグナル伝達タンパクであるβカテニンを中心に核内に入り、CBPとくっつくことにより増殖のシグナルを出し、がんがどんどん増えていきます。
そこで、CBPと我々の化合物がくっつくことで、βカテニンとの結合を切ります。βカテニンはCBPとよく似ていますが、少しだけ違うP300という別のタンパク質と結合することにより、細胞を分化させます。
がんは増殖する病気ですので、増殖から分化に切り替えることで、がん細胞は死んでいくということが知られています。ただし、正常な細胞には、あまり悪影響を及ぼしません。
従来のように、「Wnt pathway」を細胞の外で止めてしまうと、増殖も分化もすべて止まってしまうため、強烈な毒性が出るということが知られていましたが、細胞の中で選択的に制御することでそれを避けることができます。
そこで、細胞内のPPIを制御することの重要性が再認識されています。スライド右側のグラフは、昨年9月に開催された欧州臨床腫瘍学会(ESMO2024)でエーザイが発表した、進行子宮体がんを対象とした臨床試験の16名の患者の中間データです。
投与した16名の患者のうち7名に、パーシャルレスポンス(PR)という、有意にがんが小さくなっているという効果が認められています。この最終データが、5月に米国臨床腫瘍学会(ASCO)で、エーザイから発表されると聞いています。
自社開発事業:PRI-724
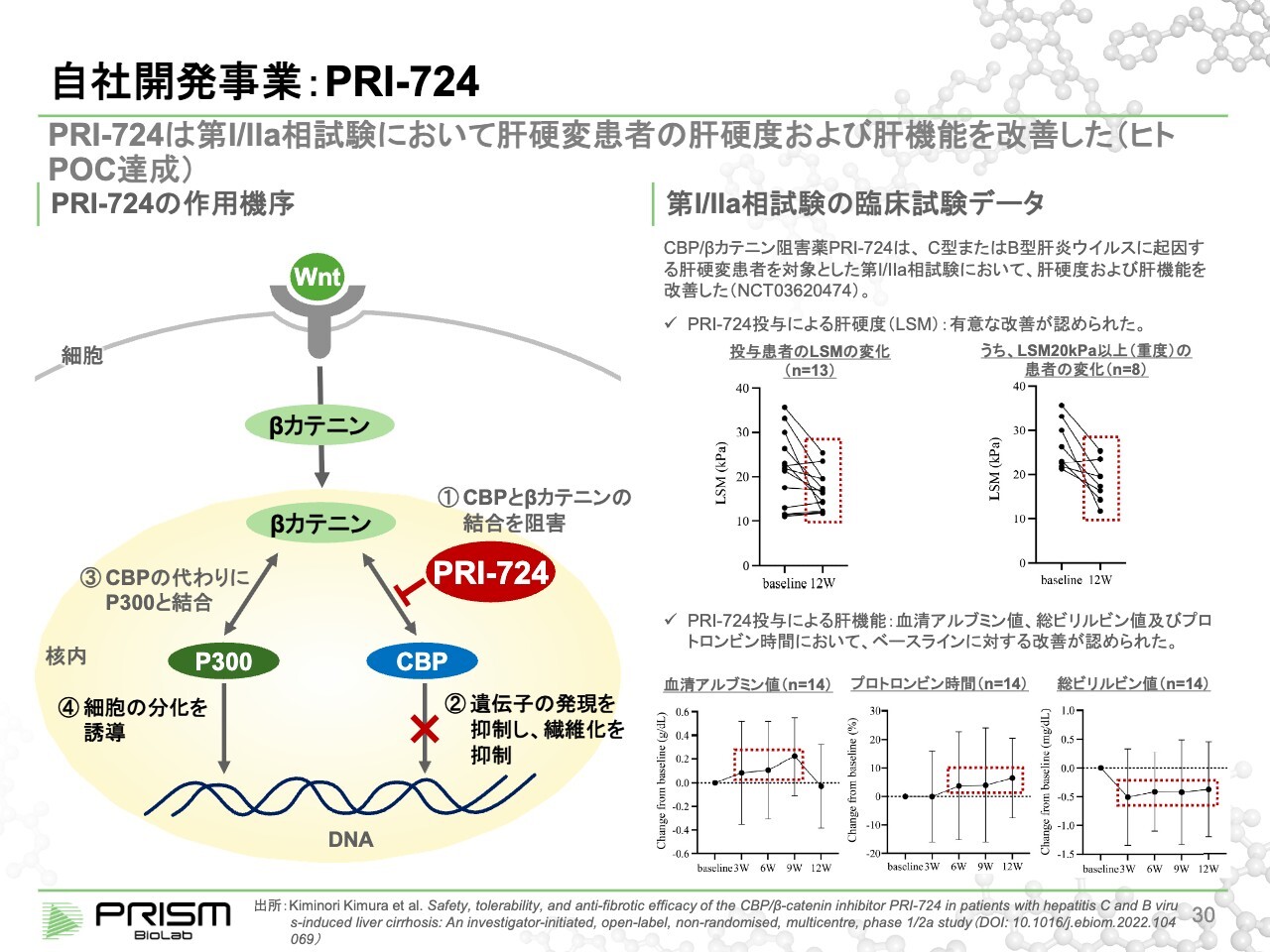
竹原:「Wnt pathway」は線維症にも関係しています。同じメカニズムで、CBPとβカテニンとがくっつくことで線維化が増進されます。「PRI-724」は肝硬変において臨床試験を進めており、こちらも同様にCBPと結合することで線維化を抑制します。
肝硬変とは、肝臓が線維化し硬くなってしまう病気です。スライド右側に記載したLSMとは肝硬度(Liver Stiffness Measurement)のことで、肝臓がどのぐらい硬くなっているかを測る指標です。
スライド右側の図にあるとおり、本来は10未満が健康ですが、肝硬変の患者は20や30に上がっています。3ヶ月の投与を行ったところ、かなり柔らかくなってきている、すなわち線維化が元に戻りつつあることが示されています。線維化はなかなか元に戻らない病気と言われてきましたので、これは画期的なデータだと考えています。
右下のグラフにあるように、肝臓の機能を示すデータも改善しています。現在はフェーズ2で、ウイルス性の肝硬変、HCV・HBVによる肝硬変、NASHによる肝硬変の患者を対象に臨床試験を進めています。
開発プロセスのイメージ:自社開発事業
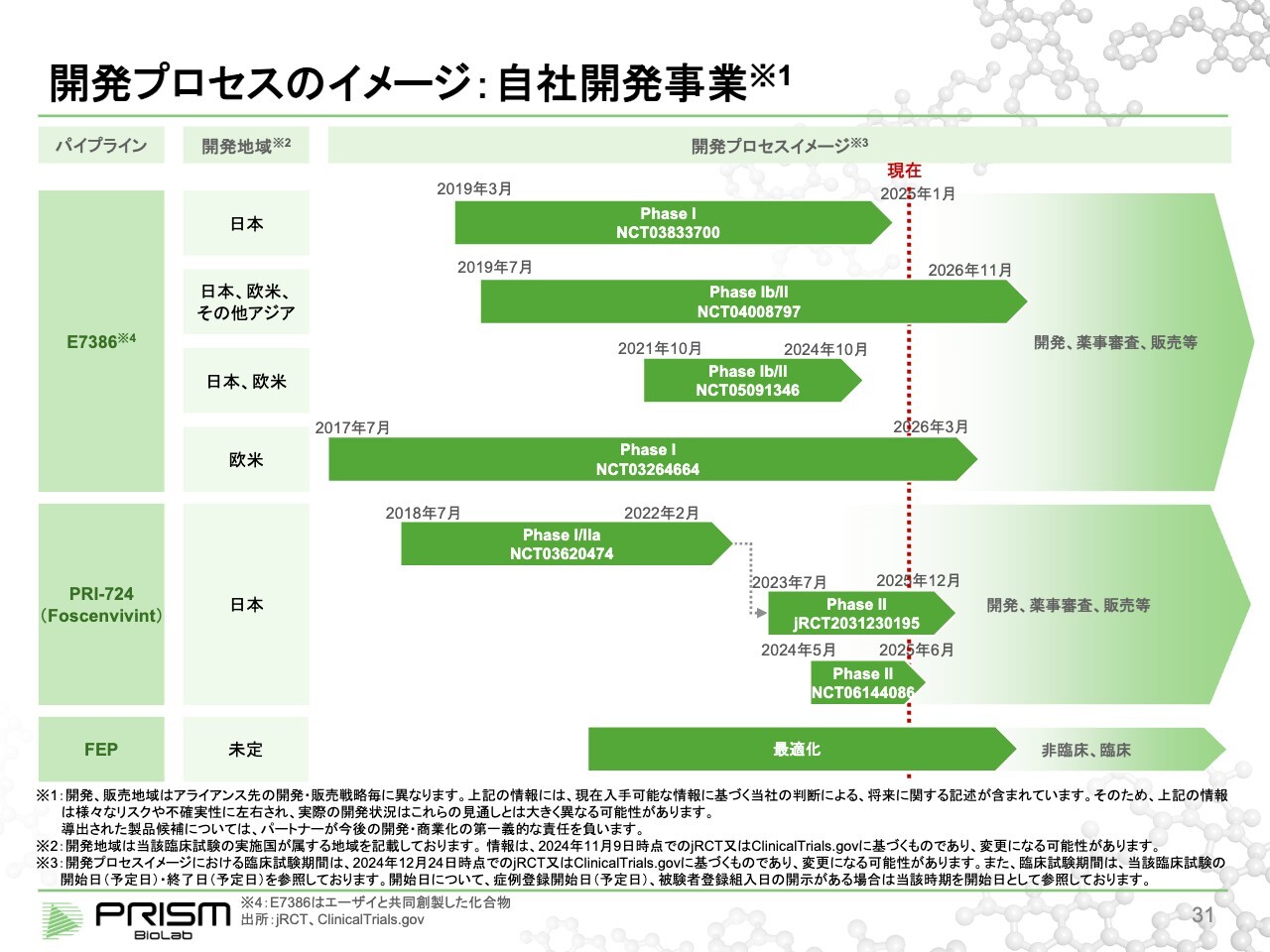
竹原:スライドは、それぞれのプログラムにおける臨床試験の進捗状況です。
共同開発事業:創薬共同研究

竹原:共同開発事業についてです。いろいろな製薬会社の持っている標的に対し、我々の技術を使ってヒットを生み出し、創薬する試みに取り組んでいます。標的や進捗は機密事項ですので、具体的にお話することは難しいのですが、Lillyから発表されている内容では、合計3つの創薬標的が対象で、マイルストン総額で約995億円という契約です。
創薬業界のパラダイムシフト

竹原:冒頭でお話ししたように、我々は新しい創薬を進めていく、今までなかなか薬ができなかったものをできるような技術を作り出していく、つまり創薬領域を作り出すことを目指しています。
創薬の歴史は新しいツールができることで、今までまったく治せなかった病気が治せるようになるということを段階的に踏んできています。例えば、天然物の煎じ薬しかなかったものを、その成分のみ単離することで効果的な薬ができます。
有効成分を単離したのはモルヒネが初めてです。あるいは、人の力で化合物を合成して薬にしたのはアスピリンが初めてでした。そのような低分子の技術ができたことで、20世紀には数多くの低分子医薬品が生まれました。
1980年代にはタンパク質が薬になる技術ができ、バイオ医薬品と呼ばれるタンパク質医薬、抗体医薬が花開きました。このような新しい技術を生み出す会社はバイオベンチャーが多く、飛躍的な成長を遂げています。
我々は、従来できなかった細胞内のPPIを制御できるような新しい創薬領域を作ることで、1つや2つではなく数多くの薬を生み出していくような、新たなパラダイムを作り出していきたいと考えています。
質疑応答:Elixとの業務提携契約について
1UP投資部屋Ken氏(以下、Ken):Kenです。よろしくお願いします。Elixさんとの業務提携で得られるメリットについて、もう少し詳しく教えてください。
竹原:先ほどもご説明したように、当社の技術の低分子はAIを使う要素が大変大きく、非常に可能性があります。AIはかなり使える環境が整ってきており、創薬の世界では特別なものではなく、みなさまが使うものになっています。
我々も、独自にいろいろなAIを使っています。例えば、化合物の物性を予測するために、独自のデータを使い、非常に高い精度で予測できるようになってきました。ただし、AIでもなかなか難しい、最先端の部分もあります。活性を上げることや、より効果的な低分子、結合度合いが高いものを作り出すことは、いくつかの領域ではできているものの、我々が狙っているPPI、タンパク質とタンパク質の結合という領域では、成功事例が少ないです。
ご存知のように、AIは学習する事例があってこそ使えるものですので、成功事例がないと新しい技術を作るのは大変難しいというのが実態です。それを実現するには、AIの中でも先端的な技術が必要になります。特に、生成AIというところ、新しい化合物をデザインしていくことが必要です。
Elixの持つ先端的なAIと、我々の独自の化合物の領域を組み合わせることで、今までできなかった画期的な薬を作り出すことが可能となります。そのような意味で、先端の技術開発は意味も大変強く、これができるようになれば、さらなる新しい創薬領域が開けるものと思っています。
質疑応答:現状で取り組めるプログラム数のキャパシティについて
Ken:現状のキャパシティについてうかがいます。現状では、どの程度のプログラム数まで対応可能なのでしょうか?
竹原:当社では、研究開発部で約40名弱のメンバーが働いており、現在は6つから7つのプログラムを走らせています。この中で、いかに効率的に進めるかに取り組んでいますが、今はだいたいあと1つか2つ増やせるような状況です。一部アウトソースすることも含め、より効率的にいかに多くのプログラムを走らせることができるかについても検討を進めています。
Ken:自社開発と共同プロジェクトがあると思いますが、これらの比率は考えておられますか? 今、自社開発では3本、共同プロジェクトでは7本くらいのプロジェクトがあると思いますが、こちらはいかがでしょうか?
竹原:現状はどちらかと言うと、共同開発のほうが少し多い段階になっています。共同開発と製薬会社とのコラボレーションという意味で大変重要ですので、ますます増やしていきたいと思っています。ただし、一定の自社開発も進めています。1対1、もしくは2対1に近い状態での共同研究が多く、現在はそのバランスで進めることが目途になっています。
質疑応答:大手製薬会社との提携を可能にした背景について
Ken:日本国内はもちろん、グローバル企業を相手に大手の製薬会社と提携できている理由について、あらためて教えていただいてもよろしいでしょうか?
竹原:ご指摘のように、当社ほど多くのグローバルファーマと提携できているバイオベンチャーは少ないです。我々が長年がんばってきたということもありますが、背景を考えてみると、やはり我々が一般にはない独自の技術を持っていることだと思っています。
大手製薬会社から見ると、彼らは何千人という研究者を抱え、さまざまな機能を内製化しています。やはり提携できるのは、彼らにもない技術を持つことが大きいと思っています。PPIを狙う低分子は困難だと言われてきましたが、我々が十分な実績も示しながら、その技術を培ってきたとところが大きいといえます。
加えて、そのようなところにチャレンジする製薬会社はそれほど多くありません。標的をがんばったとしても、ツールがないため成功確率が低く、あまり行われていません。ただし、提携している大手の製薬会社は、それでもやはりチャレンジをされています。そのような意味では、十分な余裕がなければなかなかチャレンジできないのが現状です。そのような中、やはりヒットを見つけるのが難しい時には、我々にお声掛けをいただいています。
もう1つ重要なこととして、提携する際には、ものだけを見てすぐサインということは少ないです。実際に、双方のサイエンティストがさまざまなディスカッションをしたり、パイロット的なプロジェクトを少し試したりします。
その中で、大手製薬会社は「このチームは一緒に働いて成果が出せるチームなのか」を評価されるのです。我々のサイエンティストのレベルが十分あり、「この人たちとなら一緒にできる」と評価いただいていることが、ここまで進めてこられた大きな要因だと思っています。
Ken:今も、いくつものプロジェクトが走っていると思いますが、提携できる可能性というか、大手の製薬会社と一緒に新しいことに取り組む可能性は、引き続きかなり高いと考えてよいでしょうか?
竹原:我々も、継続的にいろいろなお話をしています。やはり一番大きいのは、我々の基盤を使いたい標的が今はないため、もう少し検討しようという会社もいくつかあります。
Ken:そのようなところは、見つかり次第ということですか?
竹原:おっしゃるとおりです。
Ken:それで提携が進むということですね。
質疑応答:採用について
Ken:採用面についてうかがいます。こちらも重要な課題だと思います。例えば、Lillyやエーザイ、小野薬品工業など、非常に有名な企業と一緒に取り組んでおられます。研究者にとっても、大手企業とコラボレーションすることも、採用面でプラスに働いているでしょうか?
竹原:やはり、我々がこれだけの実績を持っていることや、グローバルな大手と対等な立場で一緒に研究していることは、研究者にとっても大変刺激的だと思います。日本の大手製薬会社を含め、我々が採用するメンバーも、日本の中でトップレベルの人たちが集まってくれています。
彼らは、やはり最終的な目標として薬を作りたいのです。薬を作ることは、1人でできるものではなく、チームワークが必要で、それぞれの役割の人すべてのレベルが高くないと、本当によいものはできません。
先ほどもお伝えしたように、世界でたった30種類から50種類しか認められていないものを、自分たちで作り出すというのは、創薬科学者にとっては本当に夢です。ほとんどの人は薬を作らないまま最後まで勤めることのほうが多く、薬を作ることは大きな勲章です。
そのためには、レベルの高い人と一緒に仕事をしたいというのが、みなさまの根本的な願いとしてあると思います。我々の組織は、社内も極めてレベルが高く、社外もトップレベルのサイエンティストたちと一緒に取り組めるということは、入社の1つの大きなモチベーションになるのではないかと思っています。
質疑応答:M&Aの可能性について
荒井沙織氏(以下、荒井):「M&Aの可能性はあるのでしょうか?」というご質問です。
竹原:M&Aは買う側、買われる側の両方のケースが考えられます。我々がどこかを吸収することは、成長可能性を考えると十分にあり得ると思います。グローバルでさまざまなベンチャーを見ても、飛躍的な拡大をする時には、そのような機能を持っているところをよく買われています。
自分たちで作り上げてもよいのですが、往々にして購入したほうが早く、優秀なサイエンティストたちを一緒に巻き込むという意味で、そのような可能性は十分あると思います。
我々が買われる可能性について、株式市場に出ている以上は常にあるわけです。我々が本当によいアセット、プログラムを多く作り出し、その技術が立証された時に、そのような可能性が出てくると思っています。
ただし、我々の本当の目的は少しでも多くの薬を作り出していく、世に送り出していくことです。我々の事業のミッション、現在のさまざまなステークホルダーの方々のことを配慮しながら、適切に対応していきたいと思っています。
荒井:御社が吸収される側ではなく、事業内容に役立つ企業を仲間に迎え入れる場合、それがAI関連の企業ということもあり得るのでしょうか?
竹原:さまざまな可能性があると思っています。ただし、取り込むことが本当にベストな方法なのかという考えもあります。
今回、Elixと業務提携したように、いろいろなパートナーとそれぞれの強みを持ち寄り、連携することで十分に成果が得られるのであれば、それも1つの手段です。これが発展していき、一緒になったほうがお互いにとってよいとなれば、仲間に迎え入れるかたちもあり得ると思います。
荒井:現状、いろいろな企業と手を組める中で、独立性があるほうがよいということですね。
竹原:おっしゃるとおり、両方の面があります。
質疑応答:「PepMetics」の分子量について
Ken:「『PepMetics』の分子量はどの程度でしょうか? ヘリックス構造やアミノ酸側鎖を変える時、合成の汎用性はあるのでしょうか? また、ヘリックス構造の特許状況などを教えてください」というご質問いただいています。
竹原:かなり専門的なご質問ですね。分子量について、平均的には400から600です。改善していく中で、最大700から800近くにはなります。従来、専門家の中では、低分子で飲み薬を作るためには、分子量は500よりも小さいほうがよいと言われていました。
しかし、最近の技術をもって、我々が実際に「PepMetics」という化合物の特性も見ながら、いろいろなテストをしている中で、経口剤にもっていくのは800くらいまでであれば十分と実績として確認しています。我々の化合物は、従来の低分子よりも少し大きめではありますが、同じような特性を持っています。
今まで作られていないのは、合成ルートが特殊で難しいという部分もあります。我々の独自の技術開発、ノウハウの蓄積により、かなり効率よくさまざまなバリエーションが合成できるようになってきています。特許的にも40種類以上の骨格をしっかり押さえており、我々の領域が確実に守れるような戦略をとっています。
質疑応答:人材採用と育成の取り組みについて
Ken:「人材採用と育成に独自の取り組みはなさっていますか?」というご質問です。
竹原:人材は本当に我々にとって一番重要な要素で、常に優秀な人材を求めています。2006年の設立から特殊な取り組みをしているわけではありませんが、最近になってみなさまに注目していただけ、採用しやすくなりました。大手製薬会社、特にLillyと小野薬品工業のようなところとの実績ができたこと、もちろん上場していることも大きいです。
製薬業界にいる日本のサイエンティストは、そのほとんどが大手製薬会社にいるわけです。バイオベンチャーに行くというのは大変なチャレンジで、リスクを取らなくてはいけません。そのような意味で、「ここなら大丈夫だろう」と認められることは重要です。
さらには「ここなら成功できる」「薬が作れる」ということも重要なポイントですので、当社はそれらが可能な環境であるということが、徐々に示せてきたというのが大きいのかと思います。2023年、2024年くらいから、本当に優秀な方から多くのご応募をいただくようになりました。
質疑応答:黒字化した先のビジョンについて
Ken:「将来的に上市して黒字化した先に、どのようなビジョンをお持ちですか?」というご質問です。
竹原:創薬というのは、当然かなり長い時間がかかります。冒頭でお話ししたように、エーザイとのプロジェクトでも今目指しているのは2031年の上市です。ロイヤリティは、その後に入ってきます。
当然、投資先行で、赤字先行になる事業ですが、先ほどKenさんにご指摘いただいたように、長期的に見れば黒字化していきます。逆に言えば、いったん黒字化すると、利益幅が非常に大きくなるのがこのビジネスの特徴です。その資金は、新しい技術の開発や規模の拡大などに使い、もちろん株主さまへの還元も重視しながら、バランスをとって進めていきたいと思っています。
竹原氏からのご挨拶
竹原:本日はお時間をいただき、ありがとうございます。バイオベンチャーというのは技術に立脚したビジネスで、成果が出るまで時間がかかるものです。次から次へとニュースが出てくるような事業体系ではないため、じっくり進めています。
創薬で最も重要なのは、人の健康のためにお役に立てることであり、研究者もそれを目標に取り組んでいます。長期のビジョンを持ち、自分たちの強みを認識して進めていきますので、ぜひ長い目でご支援いただければと思っています。どうぞよろしくお願いします。
当日に寄せられたその他の質問と回答
当日に寄せられた質問について、時間の関係で取り上げることができなかったものを、後日企業に回答いただきましたのでご紹介します。
<質問1>
質問:現在のキャッシュは37億円とのことですが、今後の研究開発費と調達の見通しを教えてください。
回答:当社は継続的に研究開発を進めていく必要があり、研究開発費は継続して10数億円かかる計画です。理想的には収益を早期に増やすことで資金を確保したいと考えています
が、必要に応じて調達も検討します。
<質問2>
質問:共同開発プロジェクトの成果が出た場合、特許の権利関係はどのようになるのでしょうか?(共同権利でしょうか?)また、特許の取得があった場合、適時開示やプレスリリースで公表予定でしょうか?
回答:特許の権利については契約形態や成果が出るまでの過程によってケースバイケースになりますが、いずれの場合も当社はマイルストン、ロイヤリティを受取れるような契約になっています。特許の取得時にはその内容に応じて適時開示を行ってまいります。